穿膜肽运载量子点等大分子进入细胞核
转运大分子进入核膜的能力,对于真核细胞功能是必需的。将分子成像探针或治疗试剂有效递送入细胞核,对于发展新的疾病诊断方法和治疗策略具有重要意义。在传统的细胞核转运中,需要转运分子具有核定位信号(Nuclear localization signal, NLS),同时需要胞浆因子(如importins、karyopherin等)和ATP的存在。美国乔治亚理工学院和埃默里大学的Gang Bao课题组发现,细胞穿膜肽——HIV-1 Tat蛋白的一段11个氨基酸组成的多肽(Tat peptide),可以运载大分子物质(包括量子点和90nm粒径的荧光微球)通过细胞浆膜和细胞核膜;分子机制研究显示,穿膜肽以不同于NLS的方式进入细胞核,不依赖胞浆因子和ATP的存在。
Nitin等合成Tat peptide,并在其羧基末端进行了生物素修饰,进而与链霉亲和素偶联的量子点反应,通过生物素-亲和素的结合而完成量子点对穿膜肽的标记(图1)。在进行细胞核摄取穿膜肽的分子机制研究中,传统有机荧光染料发生光漂白,无法进行动力学分析。而量子点没有光漂白,可结合激光共聚焦成像,生成不同时间点的荧光图像,进行动力学分析。结果显示,量子点标记穿膜肽的浓度比NLS多肽低1000倍,其动力学速率常数更高。该项研究对于发展递送大分子或纳米颗粒进入细胞核的新技术具有重要意义。
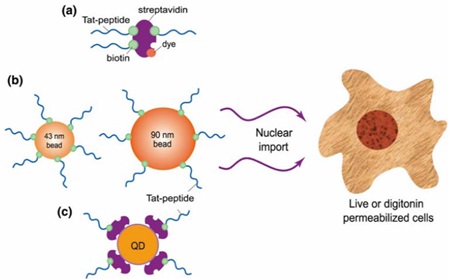
图1 有机染料(a)、荧光微球(b)及量子点(c)的穿膜肽标记模式图。
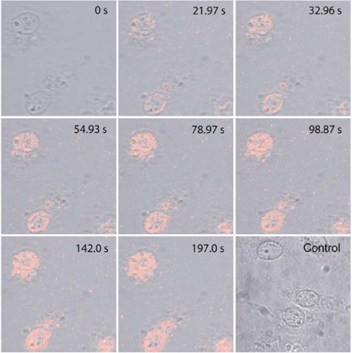
图2量子点标记的穿膜肽进入细胞核的激光共聚焦图片。
文献来源:


